Ատոմի կառուցվածքը
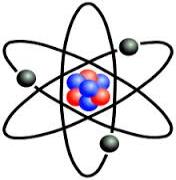 Ատոմ հունարեն նշանակում է անբաժանելի. քիմիական ճանապարհով այն չի բաժանվում, սակայն ֆիզիկական ճանապարհով այն բաժանվում է առավել փոքր, այսպես կոչված տարրական մասնիկների:
Ատոմն ունի բարդ կառուցվածք, այն կազմված է դրական լիցքավորված միջուկից և նրա շուրջը գտնվող բացասական լիցք ունեցող էլեկտրոններից:
Միջուկն իր հերթին կազմված է դրական լիցք ունեցող մասնիկներից` պրոտոններից և զանգվածով պրոտոնին մոտավորապես հավասար, բայց լիցք չունեցող մասնիկներից` նեյտրոններից:
Քիմիական ռեակցիաների ընթացքում ատոմի միջուկի բաղադրության փոփոխություն տեղի չի ունենում:
Միջուկի շուրջը առկա էլեկտրոնների թիվը հավասար է միջուկում առկա պրոտոնների թվին, հետևաբար, ատոմն էլեկտրաչեզոք է: Պրոտոնների թիվը հավասար է միջուկի դրական լիցքին կամ քիմիական տարրերի պարբերական համակարգում այդ տարրի ատոմային համարին (կարգաթվին):
Նեյտրոնները, տեղավորվելով դրական լիցքավորված պրոտոնների միջև, խոչընդոտում են նրանց փոխադարձ վանումը: Նեյտրոնների թիվը ատոմի միջուկում պրոտոնների թվից կամ մեծ է, կամ էլ հավասար:
Ատոմի զանգվածը հիմնականում պայմանավորված է միջուկի զանգվածով:
Միջուկի նույն դրական լիցքով ատոմների համախումբը անվանում են քիմիական տարր: Դրանք հաճախ հանդիպում են տարատեսակ ատոմների ձևով, որոնք տարբերվում են միջուկում պարունակվող նեյտրոնների թվով:
Միևնույն քիմիական տարրի ատոմները, որոնք տարբերվում են նեյտրոնների թվով, հետևաբար և զանգվածային թվով, անվանում են իզոտոպներ:
Էլեկտրոնների թիվը ատոմի էլեկտրոնային թաղանթում հավասար է ատոմի միջուկում պրոտոնների թվին, որը որոշվում է Մենդելեևի պարբերական համակարգում տարրի կարգաթվով կամ ատոմային համարով:
Այսպես, ջրածնի ատոմի էլեկտրոնային թաղանթը կազմված է մեկ էլեկտրոնից, կալցիումինը՝ 20, արծաթինը՝ 47:
Իսկ ինչպե՞ս են շարժվում էլեկտրոնները: Քաոսայի՞ն, վառվող լամպի շուրջը պտտվող մժեղների նմա՞ն, թե՞ որոշակի կարգավորվածությամբ: Այդ հարցի պատասխանը կարելի է գտնել՝ դիտարկելով էլեկտրոնի էներգիական բնութագիրը:
Էլեկտրոններն ատոմում տարբերվում են իրենց էներգիայով: Ինչպես ցույց են տալիս փորձնական արդյունքները, որոշ էլեկտրոններ ավելի ուժեղ են ձգվում միջուկի կողմից, մյուսները՝ ավելի թույլ: Այս երևույթի գլխավոր պատճառը էլեկտրոնների տարբեր հեռավորությունն է ատոմի միջուկից:
Ատոմ հունարեն նշանակում է անբաժանելի. քիմիական ճանապարհով այն չի բաժանվում, սակայն ֆիզիկական ճանապարհով այն բաժանվում է առավել փոքր, այսպես կոչված տարրական մասնիկների:
Ատոմն ունի բարդ կառուցվածք, այն կազմված է դրական լիցքավորված միջուկից և նրա շուրջը գտնվող բացասական լիցք ունեցող էլեկտրոններից:
Միջուկն իր հերթին կազմված է դրական լիցք ունեցող մասնիկներից` պրոտոններից և զանգվածով պրոտոնին մոտավորապես հավասար, բայց լիցք չունեցող մասնիկներից` նեյտրոններից:
Քիմիական ռեակցիաների ընթացքում ատոմի միջուկի բաղադրության փոփոխություն տեղի չի ունենում:
Միջուկի շուրջը առկա էլեկտրոնների թիվը հավասար է միջուկում առկա պրոտոնների թվին, հետևաբար, ատոմն էլեկտրաչեզոք է: Պրոտոնների թիվը հավասար է միջուկի դրական լիցքին կամ քիմիական տարրերի պարբերական համակարգում այդ տարրի ատոմային համարին (կարգաթվին):
Նեյտրոնները, տեղավորվելով դրական լիցքավորված պրոտոնների միջև, խոչընդոտում են նրանց փոխադարձ վանումը: Նեյտրոնների թիվը ատոմի միջուկում պրոտոնների թվից կամ մեծ է, կամ էլ հավասար:
Ատոմի զանգվածը հիմնականում պայմանավորված է միջուկի զանգվածով:
Միջուկի նույն դրական լիցքով ատոմների համախումբը անվանում են քիմիական տարր: Դրանք հաճախ հանդիպում են տարատեսակ ատոմների ձևով, որոնք տարբերվում են միջուկում պարունակվող նեյտրոնների թվով:
Միևնույն քիմիական տարրի ատոմները, որոնք տարբերվում են նեյտրոնների թվով, հետևաբար և զանգվածային թվով, անվանում են իզոտոպներ:
Էլեկտրոնների թիվը ատոմի էլեկտրոնային թաղանթում հավասար է ատոմի միջուկում պրոտոնների թվին, որը որոշվում է Մենդելեևի պարբերական համակարգում տարրի կարգաթվով կամ ատոմային համարով:
Այսպես, ջրածնի ատոմի էլեկտրոնային թաղանթը կազմված է մեկ էլեկտրոնից, կալցիումինը՝ 20, արծաթինը՝ 47:
Իսկ ինչպե՞ս են շարժվում էլեկտրոնները: Քաոսայի՞ն, վառվող լամպի շուրջը պտտվող մժեղների նմա՞ն, թե՞ որոշակի կարգավորվածությամբ: Այդ հարցի պատասխանը կարելի է գտնել՝ դիտարկելով էլեկտրոնի էներգիական բնութագիրը:
Էլեկտրոններն ատոմում տարբերվում են իրենց էներգիայով: Ինչպես ցույց են տալիս փորձնական արդյունքները, որոշ էլեկտրոններ ավելի ուժեղ են ձգվում միջուկի կողմից, մյուսները՝ ավելի թույլ: Այս երևույթի գլխավոր պատճառը էլեկտրոնների տարբեր հեռավորությունն է ատոմի միջուկից:

Միջուկն իր հերթին կազմված է դրական լիցք ունեցող մասնիկներից` պրոտոններից և զանգվածով պրոտոնին մոտավորապես հավասար, բայց լիցք չունեցող մասնիկներից` նեյտրոններից:
Քիմիական ռեակցիաների ընթացքում ատոմի միջուկի բաղադրության փոփոխություն տեղի չի ունենում:
Միջուկի շուրջը առկա էլեկտրոնների թիվը հավասար է միջուկում առկա պրոտոնների թվին, հետևաբար, ատոմն էլեկտրաչեզոք է: Պրոտոնների թիվը հավասար է միջուկի դրական լիցքին կամ քիմիական տարրերի պարբերական համակարգում այդ տարրի ատոմային համարին (կարգաթվին):
Նեյտրոնները, տեղավորվելով դրական լիցքավորված պրոտոնների միջև, խոչընդոտում են նրանց փոխադարձ վանումը: Նեյտրոնների թիվը ատոմի միջուկում պրոտոնների թվից կամ մեծ է, կամ էլ հավասար:
Ատոմի զանգվածը հիմնականում պայմանավորված է միջուկի զանգվածով:
Միջուկի նույն դրական լիցքով ատոմների համախումբը անվանում են քիմիական տարր: Դրանք հաճախ հանդիպում են տարատեսակ ատոմների ձևով, որոնք տարբերվում են միջուկում պարունակվող նեյտրոնների թվով:
Միևնույն քիմիական տարրի ատոմները, որոնք տարբերվում են նեյտրոնների թվով, հետևաբար և զանգվածային թվով, անվանում են իզոտոպներ:
Էլեկտրոնների թիվը ատոմի էլեկտրոնային թաղանթում հավասար է ատոմի միջուկում պրոտոնների թվին, որը որոշվում է Մենդելեևի պարբերական համակարգում տարրի կարգաթվով կամ ատոմային համարով:
Այսպես, ջրածնի ատոմի էլեկտրոնային թաղանթը կազմված է մեկ էլեկտրոնից, կալցիումինը՝ 20, արծաթինը՝ 47:
Իսկ ինչպե՞ս են շարժվում էլեկտրոնները: Քաոսայի՞ն, վառվող լամպի շուրջը պտտվող մժեղների նմա՞ն, թե՞ որոշակի կարգավորվածությամբ: Այդ հարցի պատասխանը կարելի է գտնել՝ դիտարկելով էլեկտրոնի էներգիական բնութագիրը:
Էլեկտրոններն ատոմում տարբերվում են իրենց էներգիայով: Ինչպես ցույց են տալիս փորձնական արդյունքները, որոշ էլեկտրոններ ավելի ուժեղ են ձգվում միջուկի կողմից, մյուսները՝ ավելի թույլ: Այս երևույթի գլխավոր պատճառը էլեկտրոնների տարբեր հեռավորությունն է ատոմի միջուկից:
Комментарии
Отправить комментарий