Էլեկտրոլիզ
Էլեկտրոլիզ, ֆիզիկաքիմիական գործընթաց, էլեկտրական հոսանքով նյութի քայքայում։ Իոնները ստանում են ուղղորդված շարժում, երբ էլեկտրոլիտի լուծույթը կամ հալույթը տեղավորում են էլեկտրական դաշտում։ Դրական լիցքավորված իոնները՝ կատիոնները, շարժվում են դեպի բացասական[1] էլեկտրոդը՝ կաթոդը, իսկ անիոնները՝ դեպի դրական լիցք կրող էլեկտրոդը՝ անոդը։
Որպես իներտ էլեկտրոդներ, սովորաբար օգտագործվում են գրաֆիտից, պլատինից և չժանգոտվող պողպատից պատրաստված թիթեղներ։ Կաթոդն ունի ավելցուկային էլեկտրոդներ, որոնք շարունակ մատակարարվում են հաստատուն հոսանքի աղբյուրից, իսկ անոդը, ընդհակառակը, ունի էլեկտրոնային մեծ
պակասորդ (դեֆիցիտ)։
Էլեկտրոլիզն իրականացնում են էլեկտրոլիզարար կոչվող տաշտակում, որը պարունակում է էլեկտրոլիտի լուծույթ կամ հալույթ, և որի մեջ տեղադրվում են հաստատուն հոսանքի աղբյուրին միացված էլեկտրոդներ։
Էլեկտրոլիզի համար չի պահանջվում հոսանքի մեծ լարում, բավարար է միայն մի քանի վոլտը, սակայն անհրաժեշտ է հոսանքի մեծ ուժ (ամպեր), քանի որ էլեկտրոլիզին մասնակցում են վիթխարի թվով էլեկտրոններ։ Էլեկտրոլիզն ունի մեծ կիրառություն մետաղարտադրությունում և քիմիական արդյունաբերության զանազան ճյուղերում։

Էլեկտրոլիզարարի գծապատկերը
Ֆարադեյի առաջին օրենք
Ֆարադեյի I օրենքը հետևյալն է, անջատված նյութերի m զանգվածները համեմատական են էլեկտրոլիտով անցած q էլեկտրականության քանակին,
որտեղ k-ն տվյալ նյութի էլեկտրաքիմիական համարժեքն է։
Հետևություն Ֆարադեյի օրենքներից
- (1)
- (2)
- (3)
- (4)
- , որտեղ z - նյութերի ատոմի (իոնի) վալենտականությունն է, e - լիցքավորված էլեկտրոնն է (5)
(2)-(5) բանաձևերը տեղադրելով (1) բանաձևի մեջ, կստացվի
որտեղ - Ֆարադեյի հաստատուն է։
Օրինակներ
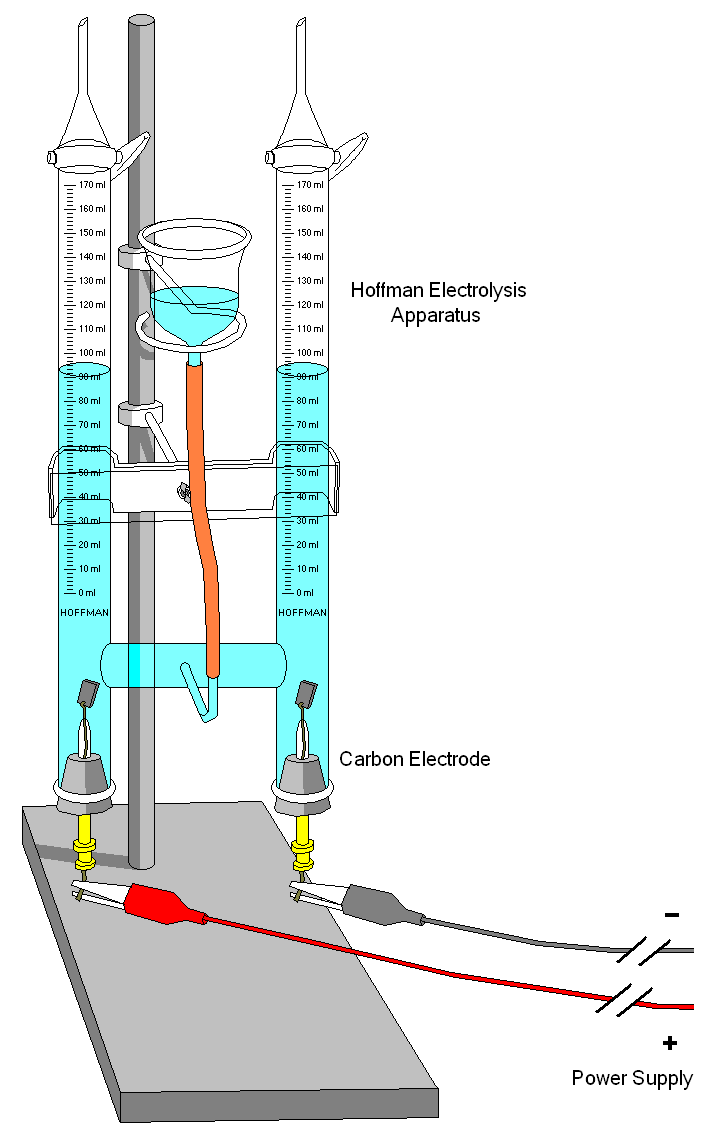
էլեկտրոլիզի ապարատի, որն օգտագործվում է դպրոցական լաբորատորիաներում
NaCl-ի հալույթի էլեկտրոլիզ
Հալույթում աղը լրիվ տրոհվում, դիսոցվում է իոնների, այս անգամ՝ արդեն առանց ջրի մոլեկուլների մասնակցության։
Կերակրի աղը իոնական միացություն է, հալույթում ևս դիսոցված է իոնների։ Էլեկտրոլիզի ջերմաստիճանը մոտ 800 °C է.
Նատրիումի կատիոնը, որ զրկված է էլեկտրոնից, մոտենալով կաթոդին, վերցնում է այնտեղից էլեկտրոն և վերածվում ատոմային նատրիումի։ Նատրիումի կատիոնը վերականգնվում է՝ օքսիդացման աստիճանն փոքրանում է, և կաթոդի մոտ կուտակվում է մետաղական նատրիում
-
- K"Կաթոդ"(-) :
Կաթոդի վրա միշտ կատարվում է վերականգնման գործընթաց։ Քլորիդ իոնը, ընդհակառակը, ունի էլեկտրոնի ավելցուկ, և անոդին մոտենալիս վերջինս խլում է այդ էլեկտրոնն, ու տեղի է ունենում քլորիդ իոնի օքսիդացում։ Երկու ատոմ, միանալով իրար, առաջացնում են քլորի մոլեկուլ։ Անոդի մոտ անջատվում է քլոր գազը։
-
- A"Անոդ"(+) :,
Անոդի վրա միշտ կատարվում է օքսիդացման գործընթաց։
Կերակրի աղի հալույթի էլեկտրոլիզի ընդհանուր հավասարումն ունի այսպիսի տեսք.
Էլեկտրոլիտների, մասնավորապես աղերի ջրային լուծույթների էլեկտրոլիզը մի փոքր ավելի բարդ է, քանի որ էլեկտրոդային գործընթացներին կարող են մասնակից դառնալ ջրից գոյացած H+ և OH– իոնները կամ հենց ջրի մոլեկուլները։ Այս դեպքերում անհրաժեշտ է հաշվի առնել կաթոդային և անոդային գործընթացների օրինաչափությունները, որոնք կախված են լուծույթում առկա կատիոնների և անիոնների բնույթից։
Կաթոդային օրինաչափություններ
- Եթե աղի մետաղի տեղը էլեկտրաքիմիական շարքում գտնվում է լիթիումից մինչև ալյումինը (ներառյալ), օրինակ՝ K, Na, Ca, ապա կաթոդի մոտ վերականգնվում է ոչ թե մետաղի կատիոնը, այլ ջուրը։
- Եթե աղի մետաղը ալյումինից հետո է՝ մինչև ջրածինը, օրինակ՝ Zn, Ni, Fe, ապա կաթոդի մոտ վերականգնվում է և՛ ջուրը, և՛ մետաղի կատիոնը։
- Եթե աղի մետաղը ջրածնից հետո է, օրինակ՝ Cu, Ag, ապա վերականգնվում է միայն մետաղը, իսկ ջրի հետ փոփոխություն տեղի չի ունենում։
Անոդային գործընթացներ
- Եթե աղի անիոնը անթթվածին թթվից է, օրինակ՝ Cl–, Br–, Ι–, S2–, ապա անոդի մոտ օքսիդանում է անիոնը, իսկ ջուրը մնում է անփոփոխ։
- Եթե անիոնը թթվածնավոր թթվից է, օրինակ՝ SO2−4, NO−3, CO2−3, PO3−4,
ապա օքսիդանում է միայն ջուրը, իսկ անիոնը մնում է անփոփոխ։
NaCl–ի ջրային լուծույթի էլեկտրոլիզ
Ջրային լուծույթում, նատրիումի և քլորի իոններից բացի, կան նաև ջրի մոլեկուլներ.
Չնայած նատրիումի իոնները ձգվում և հավաքվում են կաթոդի մոտ, սակայն կաթոդից էլեկտրոն վերցնում են միայն ջրի մոլեկուլները։ Այսինքն՝ վերականգնվում է ջուրը՝ H2O։ Նկատի ունենալով ջրի մեջ ջրածնի (+1) և թթվածնի (–2) օքսիդացման աստիճանները՝ կարելի է եզրակացնել, որ վերականգնվելու հնարավորություն ունի միայն ջրածինը։ Օքսիդացման աստիճանը կարող է նվազել մինչև զրո (0)։ Ընդ որում՝ փոփոխությունը կատարվում է ջրածնի միայն մեկ ատոմի հետ (HOH), իսկ լուծույթում աստիճանաբար ավելանում են հիդրօքսիդ՝ OH–, իոնները.
-
- K"Կաթոդ"(-) :
Այս գործընթացը անվանում են «ջրի կաթոդային վերականգնում».
Անոդի վրա օքսիդանում են քլորիդ իոնները, իսկ ջրի մոլեկուլների հետ փոփոխություն տեղի չի ունենում։
- A"Անոդ"(+) ::
Կերակրի աղի ջրային լուծույթի էլեկտրոլիզի դեպքում ծախսվում է և՛ աղը, և՛ ջուրը։ Անջատվում են ջրածին և քլորգազերը, իսկ լուծույթը հարստանում է Na+ և OH– իոններով, այսինքն՝ նատրիումի հիդրօքսիդով։ Գումարային հավասարումն ունի հետևյալ տեսքը.
Այս ճանապարհով արդյունաբերության մեջ ստանում են ալկալիներ՝ NaOH, KOH, քլոր։
Նշանակություն
Հայաստանում գոյություն ունի պղնձի արտադրություն, որում օգտագործվում են հրամետալուրգիան և էլեկտրոլիզը։
Աղերի հալույթների և ջրային լուծույթների էլեկտրոլիզը լայնորեն օգտագործվում է ամենատարբեր նյութեր՝ մետաղներ, ալկալիներ, թթուներ, ջրածին, թթվածին, քլոր ստանալու, ինչպես նաև զանազան իրեր և առարկաներ պղնձապատելու, արծաթապատելու, ոսկեզօծելու համար։
Օրինակ՝ թեյնիկները, մարդատար ավտոմեքենաների որոշ մետաղյա մասերը նիկելապատելու համար դրանք մտցնում են նիկելի աղի լուծույթ պարունակող էլեկտրոլիզային տաշտակի մեջ, միացնում են կաթոդին և կատարում էլեկտրոլիզ։ Վերականգնվող մետաղական նիկելը բարակ շերտով նստում է որպես կաթոդ ծառայող այդ իրերի վրա։ Նիկելապատված մետաղյա իրերը ոչ միայն գեղեցիկ տեսք ունեն, այլև ավելի կայուն են զանազան ֆիզիկական և քիմիական ազդակների նկատմամբ։
Ծանոթագրություններ
Գրականություն
- Handbuch der experimentellen Chemie Sekundarbereich II, Band 6։ Elektrochemie, Aulis Verlag Deubner GmbH & Co. KG
- Ullmann Encyklopädie der technischen Chemie 3. Auflage, Band 6, S. 253–304; 4. Auflage, Band 3, S. 262–298, 5. Auflage, Band A9, S. 220 ff..
- Gerd Wedler, Lehrbuch der Physikalischen Chemie, Verlag Chemie 1982, ISBN 3-527-25880-9, S. 172–212, S. 405–445, S. 821–836
- Udo R. Kunze, Grundlagen der quantitativen Analyse, Georg Thieme Verlag, Oktober 1980, S. 169–171.
- Carl H. Hamann, Wolf Vielstich։ Elektrochemie, 4. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 3-527-31068-1 .
- B. Speiser։ Elektroanalytische Methoden I: Elektrodenreaktionen und Chronoamperometrie, in։ Chemie in unserer Zeit1981, 15, 21–26; .
- W.-D. Luz, E. Zirngiebel։ Die Zukunft der Elektrochemie, Einige Betrachtungen aus der Sicht der Chemie, in։ Chemie in unserer Zeit, 1989, 23, 151–160; .
Արտաքին հղումներ
- Էլեկտրոլիզի ժամանակ առաջացող գործընթացներ
- «Էլեկտրոլիզ» Հոդված (Քիմիական հանրագիտարան)
- Էլեկտրոդիալիզ
- Էլեկտրոֆլոտացիա
Գերլարվածություն, էլեկտրաքիմիական, էլեկտրոդի հավասարակշիռ պոտենցիալի փոփոխությունը էլեկտրոլիզի ընթացքում, պայմանավորված էլեկտրաքիմիական բևեռացմամբ։ Տարբերում են կաթոդային և անոդային գերլարվածություն։ Դրանց արժեքը կախված է էլեկտրոդային ռեակցիայի տեսակից, հոսանքի խտությունից, լուծիչի և էլեկտրոդի բնույթից և այլն։ Գերլարվածության առաջացումը պայմանավորված է էլեկտրաքիմիական ռեակցիայի փուլերից մեկի դանդաղ ընթացքով և էլեկտրոդի մոտակայքում լուծույթի կոնցենտրացիայի փոփոխմամբ։ Գերլարվածության ամենամեծ արժեքները դիտված են ջրածնի և թթվածնի էլեկտրաքիմիական անջատման դեպքում (ջրի էլեկտրոլիզ)։
Էլեկտրաքիմիա
Էլեկտրաքիմիա, ֆիզիկական քիմիայի բաժին, ուսումնասիրում է իոններ պարունակող համակարգեր, ինչպես նաև երկու ֆազերի սահմանում լիցքավորված մասնիկների (իոնների և էլեկտրոնների) մասնակցությամբ ընթացող պրոցեսներ։ Երկֆազ համակարգում ֆազերից մեկը մետաղ է կամ կիսահաղորդիչ, մյուսը՝ էլեկտրոլիտի լուծույթ կամ հալույթ։ Տվյալ դեպքում էլեկտրոքիմիան գիտություն է, որն ուսումնասիրում է մետաղի կամ կիսահաղորդիչի լիցքերի փոխազդեցությունը լուծույթի իոնների և մոլեկուլների կամ հալույթի իոնների հետ։
Կոլբեյի էլեկտրոլիզ
Կոլբեյի էլեկտրոլիզ կամ Կոլբեյի ռեակցիա, օրգանական ռեակցիա է հայտնաբերված Հերման Կոլբեյի կողմից։ Կոլբեյի ռեակցիան իրենից ներկայացնում է երկու կարբոնաթթուների դեկարբոքսիլային դիմերիզացում։
Եթե օգտագործենք երկու տարբեր ամինաթթուներ, ապա հնարավոր է ստանալ ածխաջրածինների խառնուրդ։
R1COO− + R2COO− → R1−R1 + R1−R2 + R2−R2
Նատրիումի բրոմատ
Նատրիումի բրոմատ, անօրգանական միացություն, ալկալիական մետաղ նատրիումի և բրոմային թթվի աղը (NaBrO3), անգույն բյուրեղներ, լավ լուծվում է ջրում։
Նատրիումի հիպոքլորիտ
Նատրիումի հիպոքլորիդ, NaOCl, անօրգանական միացություն, հիպոքլորաթթվի նատրիումական աղը։ Ջրային լուծույթի առօրյա անվանումը՝ «լաբարակյան ջուր» կամ «ժավելաջուր»։
Միացությունը սովորական բաղադրությամբ շատ անկայուն է, հեշտությամբ օգտագործվում է պենտահիդրատի՝ NaOCl · 5H2O կամ ջրային լուծույթի տեսքով, որը ունի քլորին բնորոշ սուր հոտ և բավականին բարձր կոռոզման հատկություն։
Միացություն՝ ուժեղ օքսիդիչ է, պարունակում է 95,2 % ակտիվ քլոր։ Այն ունի հականեխիչ և վարակազերծիչ հատկություն։ Օգտագործվում է վիրակապերի բաղադրության, սպիտակեղենի սպիտակեցման, վարակների, մաքրման միջոցների, ջրի ախտահանման մեջ և մի շարք քիմիական երևույթների մեջ ունի օքսիդիչ հատկություն։ Նրա բակտերիասպան և ստերիլիզացնող հատկությունը կիրառվում է բժշկության, սննդի արդյունաբերության և գյուղատնտեսության մեջ։
Ըստ The 100 Most Important Chemical Compounds (Greenwood Press, 2007) թերթի, նատրիումի հիպոքլորիտը մտնում է հարյուր ամենակարևոր քիմիական միացությունների մեջ։
Ջրածնային էներգետիկա
Ջրածնային էներգետիկան էներգաարտադրողության՝ էկոլոգիապես ամենամաքուր ճյուղերից է։ Այն հնարավորություն է տալիս ստանալ մեծ քանակությամբ որակյալ էներգիա՝ առանց շրջակա միջավայրը վնասելու։
Ռադիոչափական վերլուծություն
Ռադիոչափական վերլուծություն,նյութի քիմիական բաղադրության որոշման եղանակների համալիր՝ հիմնված ռադիոակտիվ իզոտոպների և միջուկային ճառագայթների ակտիվության չափման վրա։ Ուղղակի ռադիոչափական որոշման դեպքում որոշվող իոնը նստեցնում են ռադիոակտիվ իզոտոպ պարունակող լուծույթի ավելցուկով և չափում նստվածքի կամ ռեագենտի ավելցուկի ռադիոակտիվությունը։ Ռադիոչափական տիտրման եղանակն օգտագործվում է, երբ որոշվող իոնը ռեագենտի հետ առաջացնում է քիչ լուծելի կամ հեշտ լուծահանվող միացություն։ Տիտրման վերջնակետը որոշում են չափելով լուծույթի կամ էքստրակտի ռադիոակտիվությունը (ավելացվող լուծույթի ծավալի և չափված ռադիոակտիվության կախումն արտահայտող կորը բեկվում է)։ Իզոտոպային նոսրացման եդանակը հիմնված է տարրի իզոտոպների քիմիական հատկությունների նույնության վրա։ Վերլուծվող նմուշի վրա ավելացվում է որոշվող տարրի որոշակի քանակություն (ա0), որը պարունակում է այդ տարրի ռադիոակտիվ իզոտոպ և ունի հայտնի ռադիոակտիվություն (10)։ Որևէ մատչելի եղանակով (նստեցում, էլեկտրոլիզ են) անջատում են որոշվող տարրի մի մասը (mi) և չափում նրա ռադիոակտիվությունը։ Որոշվող նյութի պարունակությունը հաշվում են m= —֊ mi—m0 բանաձևով։ Ակտիվացնող վերլուծության դեպքում հետազոտվող նյութը ճառագայթում են (ակտիվացնում) միջուկային մասնիկներով կամ կոշտ 7ճառագայթներով և չափում առաջացած ռադիոակտիվ իզոտոպների ռադիոակտիվությունը, որն ուղիղ համեմատական է որոշվող տարրի ատոմների թվին և կախված է տվյալ միջուկային ռեակցիայի բնույթից։ Ֆոտոնեյարոնային հղանակը հիմնված է մեծ էներգիա ունեցող Y-քվանտների ազդեցությամբ որոշվող տարրի ատոմների միջուկներից նեյտրոնների անջատման վրա, որոնց քանակությունը համեմատական է այդ տարրի պարունակությանը նմուշում։ Ռադիոչափական վերլուծություն կիրառում է նաև նեյտրոնների, 7 ճառագայթների,P-մասնիկների, ռադիոակտիվ իզոտոպների ռենտգենյան ճառագայթման քվանտների կլանման և էլեկտրոնների կամ պոզիտրոնների անդրադարձման վրա հիմնված եղանակներ։
Ֆարադեյի օրենքներ
Ֆարադեյի օրենքներ, էլեկտրոլիզի քանակական օրենքներ, որոնք արտահայտում են էլեկտրոլիտով անցած էլեկտրականության քանակի և էլեկտրոդների վրա անջատված նյութերի զանգվածի ու քիմիական բնույթի միջև կապը։
Կա Ֆարադեյի 2 օրենք.
Ֆիզիկայի պատմություն
Մինչև 17-րդ դարը մեխանիկան, ֆիզիկան, Երկրի մասին գիտությունները, աստղագիտությունը, նույնիսկ ֆիզիոլոգիան «բնական փիլիսոփայություն» կոչված գիտելիքների հավաքածուի մի մաս են կազմել, որը համատեղում էր բնության երևույթների մասին տեղեկությունները և այդ երևույթների պատճառների մասին արված սխալ եզրակացությունները մտահայեցողական ֆանտազիաների հետ։ Ֆիզիկայի պատմությունը որպես ինքնուրույն գիտություն սկսել է 17-րդ դարից՝ Գալիլեյի և իր աշակերտների փորձերից։ Դասական ֆիզիկայի տեսական հիմքերը ստեղծել է Նյուտոնը 17-րդ դարի վերջում։ Արագ տեխնոլոգիական զարգացման համադրությունը և դրա տեսական ըմբռնումը 18-19-րդ դարերում հանգեցրել է ֆիզիկայի էական հասկացությունների առաջացմանը (զանգված, էներգիա, իմպուլս, ատոմ և այլն) և հիմնարար օրենքների բացահայտմանը, որոնք ապացուցվել են փորձերով։
20-րդ դարի սկզբին միանգամից մի քանի բնագավառներում նկատվեց դասական ֆիզիկայի կիրառման ոլորտի սահմանափակ լինելը։ Ի հայտ եկան հարաբերականության տեսությունը, քվանտային ֆիզիկան, ստանդարտ մոդելը։ Սակայն մի քանի դեռևս չլուծված խնդիրներ շարունակում են մնալ ասպարեզում և խթանել ֆիզիկոսների՝ գիտության հետագա զարգացմանն ուղղված գործունեությանը։




















Комментарии
Отправить комментарий